반응형
1. Assumption
(1)고체와 액체에 대해 비체적 v가 변하지 않는, 비압축성이라 가정할 수 있습니다. 또한 dv ≈ 0임을 의미합니다.
v ≈ const, v is also small => dv ≈0
(2) 비열(specific heat)이 상수라 가정합니다.
2. Specific heat relation
고체와 액체에 대한 비열은 정적비열, 정압비열 구분없이 C로 주어집니다.
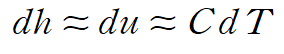
고체와 액체에서 엔탈피와 내부에너지의 차이는 아주 작습니다.
3. Entropy equation , Gibbs relation
가역과정(reversible process)에서 엔트로피 방정식은 다음과 같습니다.
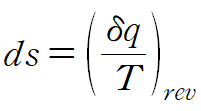
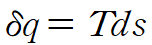
열역학 제 1법칙 관계식을 사용합니다.
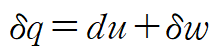
위 두 식을 조합하여 다음 관계식을 얻습니다.
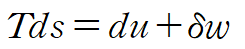
simple compressible substance라 가정하면 아래와 같이 정리됩니다.
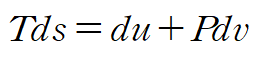
위 식을 gibbs relation(T,p,v,u,h,s 의 관계식)이라고도 하는데 고체와 액체의 경우 dv = 0 이라 할 수 있으므로
아래와 같이 정리할 수 있습니다.
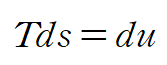
이때 고체, 액체에 대한 비열 관계식을 적용하면
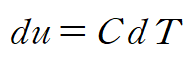
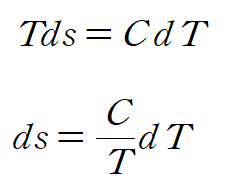
비열을 상수라 가정하고 적분하면 비열과 온도로 표현된 엔트로피를 얻을 수 있습니다.
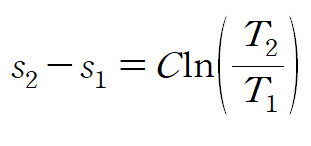
※ 이때 온도의 단위는 절대온도(K, Kelvin)를 사용합니다.
Example
(예제) 1kg의 물이 20도에서 90도로 가열할 때 비열을 상수라 가정하고 엔트로피 변화를 구하여라.
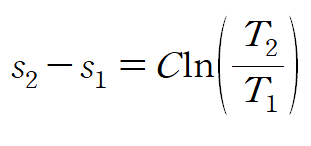
주어진 순물질이 액체이므로 위 비열-엔트로피 관계식을 사용할 수 있습니다.
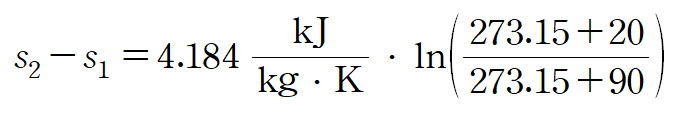
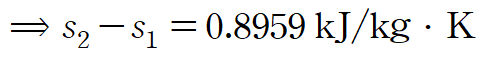
반응형
'기계공학 > 4대 역학' 카테고리의 다른 글
| [열역학] 이상기체의 엔트로피 변화 (Entropy change for an ideal gas) (0) | 2022.06.06 |
|---|---|
| [열역학] 열역학적 성질들 간의 관계식(The thermodynamic property relation ; gibbs relation) (0) | 2022.06.03 |
| [열역학] 압축인자 (Compressibility factor, Z) (0) | 2022.04.30 |
| [열역학] 이상기체 방정식 (0) | 2022.04.28 |
| [열역학] 순물질의 상 결정하는 방법 / 테이블에서 P,v,T 물성치 구하기 (0) | 2022.04.26 |